Le lien entre la norme ISO 9001 et la norme ISO 13485 est historique
La norme ISO 9001:2015 détaille les exigences relatives à un système de management de la qualité permettant à un organisme de démontrer son aptitude à fournir constamment des produits et des services conformes aux exigences clients et aux exigences légales et réglementaires applicables. Elle vise également à accroître la satisfaction client. L’ISO 9001 s’applique à tout organisme, quels que soient son type ou sa taille, ou les produits et services qu’il fournit.
La norme ISO 13485:2016 (et maintenant 2020) précise les exigences relatives à un système de management de la qualité permettant à un organisme de démontrer son aptitude à fournir des dispositifs médicaux ou services associés conformes aux exigences des réglementations applicables et des clients. Ces organismes peuvent être impliqués dans une ou plusieurs étapes du cycle de vie du dispositif médical ainsi que les prestations associées (par exemple le service après-vente, le support technique).
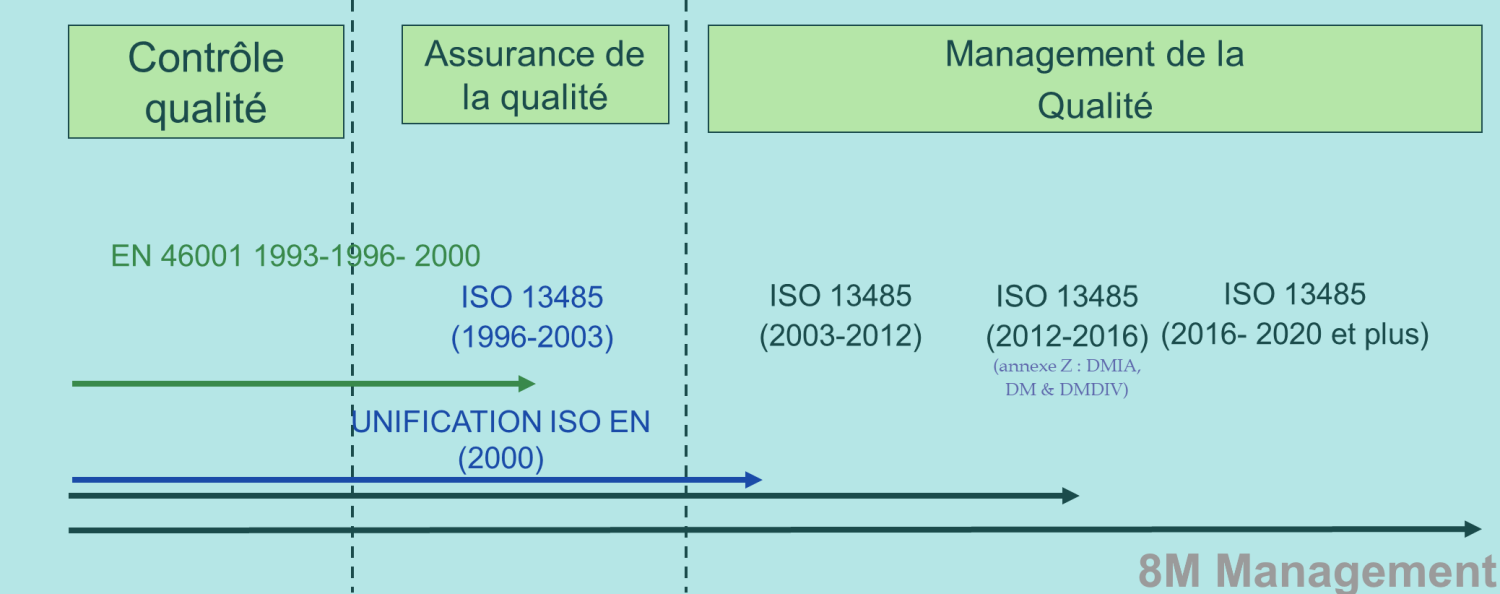
Dans cet article, je vous propose de démarrer par une reconstitution de l’historique de la norme ISO 13485.
Parce qu’un schéma vaut mieux qu’un long discours, ci-dessous un panorama des versions de 1993 à aujourd'hui.
Note
En Europe, les textes applicables pour les dispositifs médicaux (DM) sont les trois directives européennes suivantes:
- [DMIA- 90/385/CE 20/06/1990], directive concernant le rapprochement des législations des états membres relatives aux Dispositifs Médicaux Implantables Actifs.
- [DM- 93/42/CE 14/06/1993], directive relative aux Dispositifs Médicaux.
- [DMDIV- 98/79/CE], directive concernant les Dispositifs Médicaux de Diagnostic In Vitro .
Revenons quelques années en arrière…
Les premières normes ISO 9001 publiées en 1987 sont des normes d’assurance de la qualité. Elles proposent un ensemble d’exigences destinées à fournir un produit conforme et donner confiance aux clients «a priori», c'est à dire avant d'acheter le produit. Il faut savoir que l'assurance de la qualité comprend: Le contrôle qualité et la mise en place d’actions correctives et préventives.
A partir de 1990, la publication des directives DMIA et DM (voir la note ci-dessus) rend obligatoire la mise en œuvre d’un «système d’assurance de qualité» pour les fabricants de dispositifs médicaux européens.
Ceux qui connaissent les dispositifs médicaux depuis longtemps gardent peut-être un souvenir impérissable de la première norme européenne. Il s'agit de la norme EN 46001 « Systèmes de qualité. Dispositifs médicaux. Exigences particulières pour l'application de la norme EN ISO 9001». Parue en 1993, elle spécifie seulement ce qui change avec la norme ISO 9001. Tout lecteur pointilleux appréciera également la terminologie «Système de qualité», mauvaise traduction de l’anglais «Quality system». Ceci nous a compliqué la tâche auprès de nos clients, nous les consultants en qualité.
Un peu plus tard, en 1996, les normalisateurs ont enfin la bonne idée de publier une norme consolidée: EN 46001+ISO 9001. L’ISO 13485 était née ! Notons au passage que son application s’est élargie par la même occasion de l’Europe à l’international.
Année 2000 : l'avènement du management de la qualité
Il faut attendre 2000 pour que disparaisse définitivement la norme EN 46001. Pendant ce temps, la norme ISO 9001 évolue considérablement. Des nouveaux concepts apparaissent : Ce sont les huit principes du management de la qualité. Le management de la qualité prend la place de l’assurance de la qualité et on parle désormais de système de management de la qualité (SMQ).
En effet, le management de la qualité englobe: L’assurance de la qualité, l’amélioration de la qualité, la planification de la qualité et la maîtrise de la qualité.
On comprend que logiquement, la norme ISO 13485 est mise à jour avec ces nouveautés en 2003. La révision de 2012, quant à elle, consiste seulement à l’ajout de l’annexe Z : DMIA, DM & DMDIV.
La dernière révision de 2015 de la norme ISO 9001 propose l’approche par les risques. Pour ce faire, elle rend obligatoire la définition du contexte de l'organisme dans son SMQ. De plus, cette nouvelle version supprime l'obligation de rédiger des procédures définies. A juste titre, l’organisme dispose du choix de décider de ses propres procédures écrites. Et comme la digitalisation des entreprises a conduit à utiliser plus d'outils informatiques, cela s'applique également pour la qualité. Idéalement si toute l'activité est informatisée, le respect des processus qualité est garanti par les applications.
Comme on pouvait s'y attendre, l’ISO 13485 suit en 2016 l’évolution de la norme ISO 9001:2015.
Et pour finir l'historique: 2020
Bonne nouvelle, le Comité Technique 210 (ISO/TC210) de l’ISO (International Standard Organization) a reconduit en 2020 la version 2016. En d'autres termes, il la considère d’actualité pendant encore quelques années. Elle reste donc complètement adaptée aux règlements européens relatifs aux dispositifs médicaux [MDR – (UE) 2017/745] et aux dispositifs médicaux de diagnostic in vitro [IVDR – (UE) 2017/746]. Ces règlements indiquent très précisément ce qui est attendu en matière de SMQ de la part des fabricants mais également de celle des autres opérateurs.
Les différences entre l’ISO 9001 et l’ISO 13485
Une des spécificités de la norme ISO 13485 est la culture de la procédure écrite. Il faut souligner qu'elle impose 24 types de procédures écrites à fournir sous peine de non-conformités bloquantes. Ceci est valable dans toutes les configurations.
Considérons le cas par exemple où vous utilisez la Rolls Royce de la GED, avec des Workflows intégrés ne vous laissant pas la possibilité de déroger à la maîtrise documentaire. Vous devez, en tant que fabriquant de dispositifs médicaux, quand même écrire la procédure de gestion des documents et celle des enregistrements exigées par la norme ISO 13485. Cela s'explique tout à fait car il est primordial de respecter les exigences réglementaires relatives aux dispositifs médicaux, y compris pour la documentation (approbations, durées d'archivage,...).
Pour prendre un autre exemple, avec l’ISO 13485, si vous utilisez des applications informatiques, vous devez :
- D’une part, écrire la procédure de validation des applications logicielles (obligatoire).
- D’autre part, constituer le dossier de validation pour chaque application.
Là où la norme ISO 13485 se démarque
Il faut souligner ici la gestion des risques associés aux dispositifs médicaux. Elle ne doit pas se confondre avec l'approche par les risques commune aux deux normes car elle est très différente. L'ISO 13485 fait référence à la norme ISO 14971 de gestion des risques des dispositifs médicaux. Plus précisément, elle aide à identifier les dangers associés à un dispositif médical, estimer et évaluer les risques associés à ces dangers. Cela a pour objectif de maîtriser ces risques et surveiller l’efficacité des moyens de maîtrise tout au long du cycle de vie du dispositif médical.
Plus généralement dans l’ISO 13485, on trouve des exigences spécifiques tels que :
- Les documents pour les dossiers des dispositifs médicaux.
- La propreté des produits pendant la production.
- L'environnement de travail.
- La maîtrise de la contamination du produit.
- La production des dispositifs médicaux stériles.
- L’obligation de réaliser des rapports aux autorités réglementaires.
- La réalisation d’activités spécifiques après commercialisation.
- La gestion des risques selon la norme ISO 14971.
Obligation d’être certifié ISO 13485
La certification ISO 13485 n’est pas rendue obligatoire par la réglementation européenne tout comme la certification ISO 9001. Néanmoins, il faut nuancer cette interprétation. Il faut savoir que les exigences techniques édictées par la législation de l'UE sont obligatoires pour obtenir le marquage CE de ses dispositifs médicaux. C'est le sésame nécessaire pour leur commercialisation sur le marché européen. Dans ce contexte très réglementé, la norme ISO 13485 apporte une forte présomption de conformité aux directives applicables et aux nouveaux règlements européens pour la partie système de gestion de la qualité.
En règle générale, les normes harmonisées établissent des exigences techniques qui sont considérées comme étant adaptées ou suffisantes pour respecter les exigences techniques de la législation européenne. Pour cette raison, la norme ISO 13485 est l'une des normes harmonisées pour le SMQ des dispositifs médicaux (tout comme la norme ISO 14971 l'est pour la gestion des risques).
En conclusion
L'ISO 13485 prévoit l'établissement et le maintien d'un SMQ dans l'industrie des dispositifs médicaux. Seuls les fabricants et leurs sous-traitants peuvent demander une certification sur ce référentiel car il est spécifique. Bien qu'il partage le concept de SMQ tel que mentionné dans ISO 9001 et le processus de certification, il a encore des exigences techniques distinctes à respecter.
La politique qualité et le SMQ de tout organisme jouent un rôle fondamental dans la fourniture à ses utilisateurs de produits efficaces et sûrs. Il va sans dire que les utilisateurs et les autorités réglementaires (en France l’ANSM) attendent des fabricants des dispositifs médicaux qu'ils répondent aux normes qualité et sécurité.
Enfin, la certification ISO 13485 est également utile pour préparer les organismes à accéder à d’autres territoires que l’Union Européenne.
Pour conclure, l'ISO 13485 est reconnue à l'international et elle est compatible avec les exigences réglementaires des autres marchés mondiaux.
Auteur : Marie-Laure Beiso
Date de première parution : 15 février 2021
Autres ressources
[DM- 93/42/CE 14/06/1993], directive relative aux Dispositifs Médicaux (devient obsolète en mai 2021). Pour la consulter, cliquer ici.
[MDR – (UE) 2017/745], règlement sur les Dispositifs Médicaux est accessible en cliquant ici)
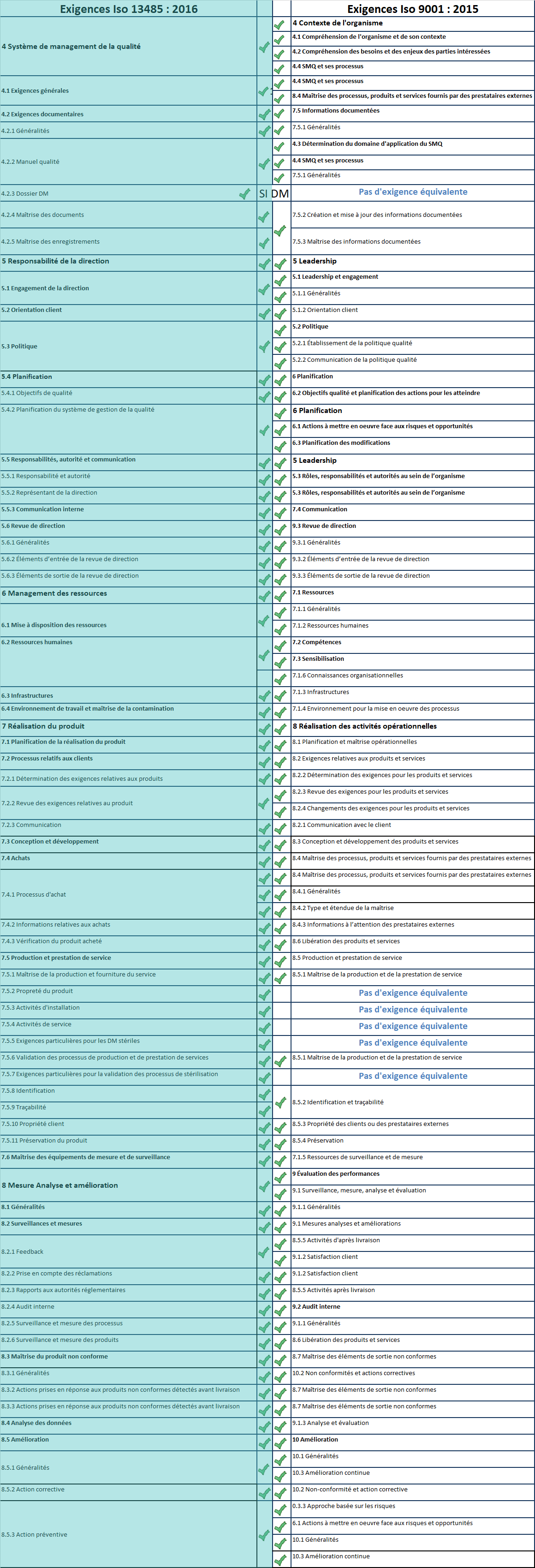
Tableau de comparaison
Voici un tableau qui résume les exigences ISO 13485 et ISO 9001. Sur la colonne la plus à droite on constate que certaines exigences de l’ISO 13485 ne sont pas applicables à l’ISO 9001.